Nhiệt phân muối Kali Clorat là một trong những phản ứng hay gặp và nổi bật nhất trong chương trình học phổ thông. Tuy nhiên không phải ai cũng nắm rõ được muối Kali Clorat công thức là gì? Phương trình phản ứng nhiệt phân KClO3 ra sao?…. Hãy cùng tìm hiểu thêm thông tin về Kali Clorat trong bài viết này cũng như để hiểu rằng liệu KClO3 có độc không nhé!
Contents
Tìm hiểu về muối Kali Clorat KClO3 là gì?
Trước khi đến với phương trình nhiệt phân KClO3 chúng ta cần nắm rõ tổng quát về muối KClO3 là loại chất gì cũng như tính chất hóa học và ứng dụng của nó.
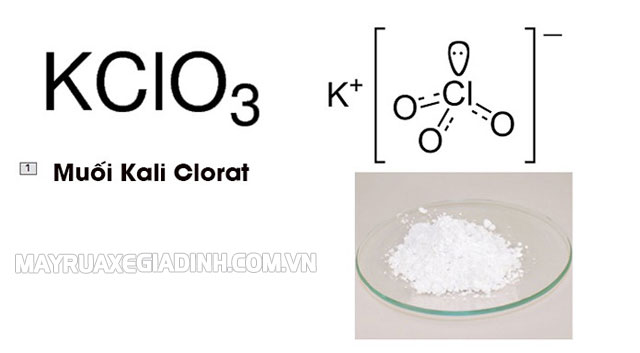
- Kali Clorat có công thức hóa học là KClO3 là một hợp chất hóa học khi ở dạng tinh khiết sẽ có kết tinh màu trắng. Nó được xem là loại clorat có nhiều ứng dụng hiện nay, được sử dụng phổ biến nhất trong công nghiệp.
- Kali Clorat là loại hóa chất mạnh, tác dụng được với nhiều kim loại và phi kim như: C (cacbon), S (lưu huỳnh), P (photpho), Al (nhôm), Mg (magie),……
- Kali Clorat là chất rắn tan nhiều trong nước, đặc biệt là nước nóng và tan ít trong nước lạnh. Ngoài ra, KClO3 có thể tan hoàn toàn trong cồn.
- Kali Clorat được ứng dụng phổ biến trong đời sống cũng như sản xuất công nghiệp. Loại clorat này được sử dụng nhiều trong các ngành công nghiệp như: ngòi nổ, thuốc đầu diêm, ngòi nổ hay thuốc giúp nhãn ra hoa.
- Kali Clorat KClO3 được điều chế chủ yếu bằng cách cho KOH tác dụng với khí Clo với điều kiện nhiệt độ trên 80℃. Phương trình phản ứng như sau:
6KOH + 3Cl2 → KClO3 + 3KCl + 3H2O
KClO3 còn có thể được điều chế bằng cách điện phân dung dịch KCl 25% ở điều kiện nhiệt độ 75℃. Phương trình phản ứng như sau:
2KCl + 2H2O → 2KOH + H2 + Cl2
6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O
Cấu tạo phân tử của muối Kali Clorat KClO3
Tổng quan về phản ứng nhiệt phân KClO3
Phản ứng nhiệt phân thực chất là một phản ứng phân hủy xảy ra dưới điều kiện có sự xúc tác của nhiệt độ. Dưới phản ứng của nhiệt độ, từ một chất bất kỳ ban đầu tham gia vào phản ứng sẽ tạo thành 2,3 hoặc nhiều chất sản phẩm khác.
Điều kiện để hình thành các chất sản phẩm này là phân cắt các liên kết kém bền trong phân tử của hợp chất vô cơ hay hữu cơ bởi nhiệt độ. Tuy nhiên, cũng cần lưu ý rằng những phản ứng điện phân nóng chảy không thuộc phản ứng nhiệt phân bởi nó phân hủy dưới tác dụng của dòng điện một chiều.
Một số trường hợp nhiệt phân thường gặp ví dụ như: nhiệt phân muối chứa oxi của clo, nhiệt phân muối sunfat, nhiệt phân muối (muối hiđrocacbonat, muối cacbonat, muối nitrat, muối amoni), nhiệt phân muối photphat, nhiệt phân muối sunfit, nhiệt phân Hidroxit,….
Trong đó, lưu ý rằng các muối sunfat gồm các muối của kim loại từ Li cho đến Ba đều rất khó để bị nhiệt phân, khi ở nhiệt độ cao những hóa chất này thường sẽ chuyển từ thể rắn sang lỏng. Ngoài ra, các bazơ không tan cũng đều bị nhiệt phân hủy ở nhiệt độ cao.
Riêng muối Kali Clorat KClO3 thì một trong những tính chất đặc trưng của hóa chất này chính là nhiệt phân. Các phản ứng nhiệt phân được chia thành phản ứng oxi hóa khử hoặc không. Và phản ứng nhiệt phân KClO3 . 5H3O chính là một phản ứng oxi hóa khử.
Phương trình nhiệt phân KClO3
Nhiệt phân KClO3 . 5H3O gồm các phương trình phản ứng nổi bật nhất như sau:
Phản ứng nhiệt phân KClO3 tạo ra muối Kali Peclorat và Kali Clorua
Điều kiện nhiệt độ 400℃:
4KClO3 ─ nhiệt → 3KClO4 + KCl
Phản ứng nhiệt phân Kali Clorat tạo thành muối Kali Clorua + O2
Điều kiện nhiệt độ 500℃:
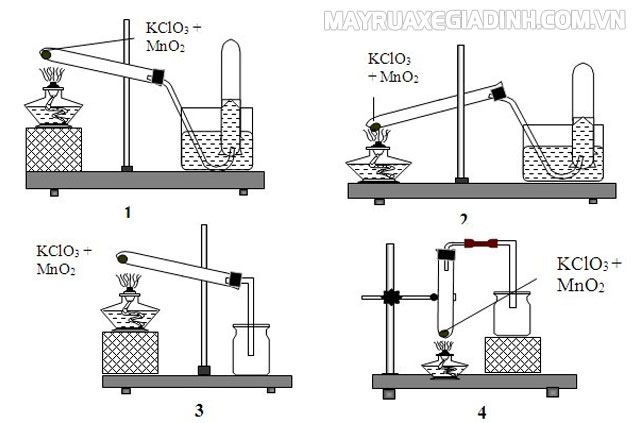
KClO3 ─ nhiệt, MnO2 → 2KCl + 3O2
Phản ứng nhiệt phân KClO3 xúc tác MnO2 này chỉ xảy ra ở nhiệt độ thấp hơn và thường thì dùng để điều chế oxi trong phòng thí nghiệm.
Ngoài ra, có thể nâng nhiệt độ lên khoảng 500℃ khi không có xúc tác của MnO2 để nhiệt phân muối KClO3 hoàn toàn, ta có phương trình như sau:
2KClO3 ─ nhiệt 500℃ → 2KCl + 3O2
Do đó, ta có thể kết luận rằng muối Kali Clorat KClO3 đơn thuần sẽ tạo ra 2 muối Kali gồm muối Clorat có tính oxi hóa KClO4 và muối clorua không có tính oxi hóa là KCl khi bị nhiệt phân hủy. Đặc biệt, nếu nhiệt phân KClO3 có thêm xúc tác MnO2 sẽ tạo thẳng ra muối KCl và O2.
Các muối khác như: Hipoclorit ClO hay muối clorit ClO2,…. cũng tương tự, sẽ có những phản ứng như sau:
2KClO ─ nhiệt độ → KClO2 + KCl
3KClO2 ─ nhiệt độ → 2KClO3 + KCl
4KClO3 ─ nhiệt độ → 3KClO4 + KCl
KClO4 ─ nhiệt độ → KCl + 2O2
Như vậy, ta có thể thấy rằng với nhiệt độ khoảng dưới 500℃, quá trình nhiệt phân muối của clo liên tục (tức là tăng số oxi hóa đến cực đại), đồng thời có xu hướng tạo ra muối KCl cùng muối có tính oxi hóa. Còn nhiệt độ cao trên 500℃ và có thể có thêm xúc tác MnO2 thì phản ứng sẽ xảy ra hoàn toàn đồng thời sinh ra muối KCl và khí O2.
Muối Kali Clorat KClO3 dùng để làm gì?
Kali Clorat được sử dụng để chế tạo thuốc nổ, ngòi nổ hay pháo hoa,….và còn dùng để làm những hỗn hợp dễ cháy khác.

Sử dụng trong dược phẩm, trong thuốc thử phân tích, đại lý nhiếp ảnh hay dùng để oxy hóa và tên lửa, tên lửa chất đẩy.
Là chất khử màu phổ biến trong dệt nhuộm vải và chất chống oxy hóa.
Kali Clorat còn là một chất không thể thiếu trong công nghiệp diêm, một trong những thành phần thuốc ở đầu que diêm (chứa gần 50% KClO3 ).

Trong phòng thí nghiệm, người ta thường sử dụng Kali Clorat để điều chế oxi dưới dạng phản ứng nhiệt phân có kèm chất xúc tác MnO2.
Tại Việt Nam, Kali Clorat được ứng dụng rộng rãi cả trong nông nghiệp và nó được xem như một loại chất giúp điều hòa cây trồng.
Bài tập về nhiệt phân KClO3
Bài tập 1: Thông qua phương trình nhiệt phân KClO3 : 2KClO3 → 2KCl + 3O2. Hãy tính khối lượng và thể tích của khí Oxi thu được sau khi nhiệt phân hoàn toàn 73,5g muối KClO3.
Hướng dẫn làm:
Ta có: nKClO3 = 73,5 /112,5 = 0,6 (mol)
Theo PTHH ta có: nO2 = 3. nKClO3/2 = 3. 0,62 = 0,9 (mol)
Khối lượng khí O2 thu được sau phản ứng là: mO2 = nO2. MO2 = 0,9 . 32 = 28,8 (g).
Vậy ở ĐKTC thì thế tích khí O2 thu được là: VO2 (đktc) = nO2. 22,4 = 0.9 . 22,4 = 20,16 (l).
Bài tập 2: Tính khối lượng Kali Clorua thu được khi nhiệt phân hoàn toàn 24,5g KClO3. Biết rằng thu được 9,6g khí O2 và muối KCl.
Hướng dẫn làm:
Ta có phương trình nhiệt phân KClO3 như sau: 2KClO3 → 2KCl + 3O2
Theo định luật bảo toàn khối lượng thì: mKCl = 24,5 – 9,6 = 14,9g
Thực hiện nung KClO3 thu được KCl và khí O2.
Bài tập 3: Dựa vào phương trình nhiệt phân KClO3 . 5H3O (có xúc tác MnO2). Để thu được 6,72 lít khí O2 ở đktc thì cần phải nhiệt phân bao nhiêu gam KClO3?
Hướng dẫn làm:
Ta có phương trình nhiệt phân KClO3 . 5H3O như sau: KClO3 → KCl + 32O2
nKClO3 = 0,33/2 = 0,2 (mol)
nKClO3 = số mol KClO3 .5H3O
Khối lượng KClO3 .5H3O là: 0,2 . 212,5 = 42,5 (g).
Lời Kết
Hy vọng rằng những câu trả lời về phương trình nhiệt phân KClO3 mà mayruaxegiadinh.com.vn vừa chia sẻ trên đây đã giúp bạn đọc có thêm kiến thức để hiểu hơn về muối Kali Clorat này, đồng thời có thể vận dụng để giải các bài tập liên quan. Hãy theo dõi chúng tôi thường xuyên để cập nhật nhiều hơn những thông tin bổ ích về mọi kiến thức thú vị nhất bạn nhé!